
药物临床试验机构百问百答-91(安控新能)
临床试验过程的分类及分期
试验方案(Protocol)是整个试验的蓝图,它叙述试验的背景、理论基础和目的,试验设计、方法和组织,包括统计学考虑、以及试验执行和完成的条件和要求。试验方案的制定依据“重复、对照、随机、均衡”的原则制定。临床试验必须依据方案进行。
1、新药研发中临床试验的种类
可以依照不同的特性、参加试验的中心的数量、对照组、是否随机、是否盲法或形式对临床试验进行分类。如果试验依照参加中心被分类,可以是单中心试验或是多中心试验。还有医学其它的标准。
如果依据临床试验的目的,则可以分为以下几类:① 以观察药物疗效为主要目的,主要为II期IDIII期临床试验;②评估药物安全性的试验:对于几乎所有的临床试验,安全性都是必不可少的观察项目,但是把安全性作为主要试验目的的试验,药品获批上市前仅见于I期临床试验,I期临床试验主要在于决定试验药物对于健康受试者临床耐受性的剂量范围,以及观察不良反应、体征或生命指数的变化;③ 药代动力学参数的评估试验;④新检查方法评估的试验:如新型的造影剂需要临床试验的验证;⑤新剂型的临床试验;⑥新给药途径的临床试验;⑦ 医疗器械的临床试验:如血糖仪、测氧仪。
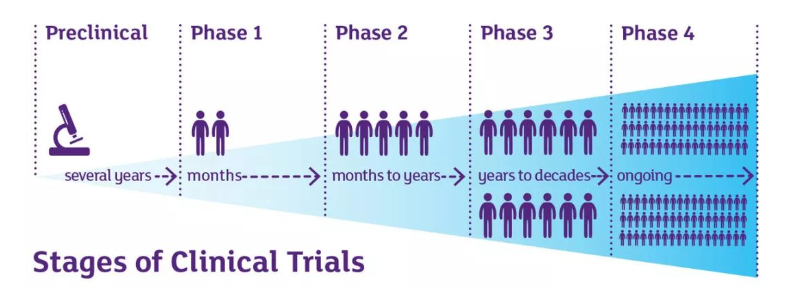
2、药物临床试验分期
I期临床试验:初步的临床药理学及人体安全性评价试验。观察人体对于新药的耐受程度和药物代谢动力学,为制定给药方案提供依据。
II期临床试验: 治疗作用摸索阶段。其目的是摸索药物对目标适应证患者的治疗作用和安全性,也包括为III期临床适应试验设计和给药剂量方案的确定提供依据。此阶段的试验设计可以根据具体的试验目的,采用多种形式,包括随机临床对照试验。
III期临床试验:治疗作用确证阶段。其目的是进一步验证药物对预期适应证患者的治疗作用和安全性, 并为利益与风险关系的评估提供依据,最终为药物注册申请获得标准提供充分的依据。试验一般是有足够样本量的随机盲法对照试验。
Ⅳ期临床试验:新药上市后由申请人自主进行的应用研究阶段。其目的是考察在广泛使用条件下的药物治疗和不良反应:评价在普通或特殊人群中使用的利益与风险关系。
从I期逐渐进入到IⅡ期的过程中,受试人群变化的特点主要有:①在I期试验中受试者主要为健康受试者,而II期为病人:② I期单一剂量,II~III期多次剂量;③ 由于I期未进行生殖毒性试验,I期为男性健康受试者,II期加入妇女:④I期,受试者通常住在病房,接受密切的观察,而II~III期受试者(病人)住在家里,定期复诊;⑤I期由研究者/研究护士给受试者服药,II~III期受试者自己带药回家自己服用;⑥用药人数(样本量),随着从I期到III期的发展,也相应增加, 因此,风险也随之增加,但是也正因为如此,人数的增加其安全性的资料也同样增多了。